Modificaciones alotrópicas del oxígeno: característica comparativa y valor
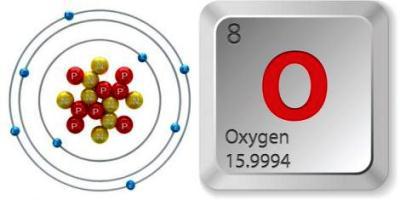
Los átomos de un tipo pueden ser parte de diferentessustancias. Para un elemento designado por el símbolo "O" (del nombre latino Oxygenium), se conocen dos sustancias simples comunes en la naturaleza. La fórmula de uno de ellos es O2, el segundo - O3. Estas son modificaciones alotrópicas del oxígeno (alótropos). Hay otros compuestos que son menos estables (O4 y O8) Comprender la diferencia entre estas formas ayudará a comparar las moléculas y las propiedades de las sustancias.
¿Qué son modificaciones alotrópicas?
Muchos elementos químicos pueden existir endos, tres o más formas. Cada una de estas modificaciones está formada por átomos de la misma especie. El científico J. Berzellius en 1841 fue el primero en llamar a este fenómeno una alotropía. La regularidad abierta se usó originalmente solo para caracterizar las sustancias de la estructura molecular. Por ejemplo, se conocen dos modificaciones alotrópicas de oxígeno, cuyos átomos forman moléculas. Más tarde, los investigadores establecieron que las modificaciones pueden estar entre los cristales. Según los conceptos modernos, la alotropía es uno de los casos de polimorfismo. Las diferencias entre las formas son causadas por mecanismos de formación de un enlace químico en moléculas y cristales. Esta característica se manifiesta principalmente en los elementos de los grupos 13-16 de la tabla periódica.
¿Cómo afecta una combinación diferente de átomos a las propiedades de la materia?
Modificaciones alotrópicas de oxígeno y ozonoestán formados por los átomos del elemento con el número ordinal 8 y el mismo número de electrones. Pero difieren en su estructura, lo que causó una discrepancia significativa en las propiedades.
| Síntomas | Oxígeno | Ozono |
Composición de la molécula | 2 átomos de oxígeno | 3 átomos de oxígeno |
| Estructura |  | |
| Estado agregado y color | Gas transparente incoloro o líquido azul pálido | Gas azul, líquido azul, sólido púrpura oscuro |
| Olor | Falta | Sharp, que recuerda a truenos, heno recién cortado |
Punto de fusión (° C) | -219 | -193 |
| Punto de ebullición (° C) | -183 | -112 |
Densidad (g / l) | 1,4 | 2,1 |
Solubilidad en agua | Ligeramente soluble | Mejor que el oxígeno |
Actividad química | En condiciones normales, estable | Es fácil de descomponer con la formación de oxígeno |
Conclusiones de los resultados de la comparación: las modificaciones alotrópicas del oxígeno no difieren en la composición cualitativa. La estructura de la molécula se refleja en las propiedades físicas y químicas de las sustancias.
¿Hay la misma cantidad de oxígeno y ozono en la naturaleza?
Una sustancia cuya fórmula O2, se produce en la atmósfera, hidrósfera, terrestrecorteza y organismos vivos. Alrededor del 20% de la atmósfera está formada por moléculas de oxígeno diatómicas. En la estratosfera a una altitud de aproximadamente 12-50 km desde la superficie de la tierra hay una capa llamada "pantalla de ozono". Su composición refleja la fórmula O3. El ozono protege nuestro planeta absorbiendopeligrosos rayos del espectro rojo y ultravioleta del sol. La concentración de la sustancia cambia constantemente, y su valor promedio es bajo - 0.001%. Por lo tanto, O2 y O3 - modificaciones alotrópicas del oxígeno, que tienen diferencias significativas en su distribución en la naturaleza.
¿Cómo obtener oxígeno y ozono?

Modificaciones alotrópicas de oxígeno y azufre
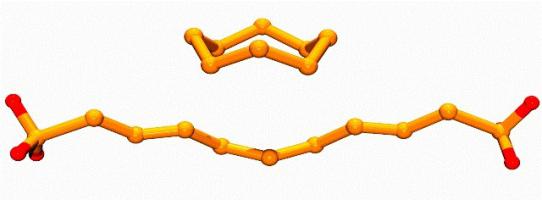
Los elementos químicos O (Oxygenium) y S (Sulphur)se ubican en el mismo grupo de la tabla periódica, se caracterizan por la formación de formas alotrópicas. De moléculas con diferentes números de átomos de azufre (2, 4, 6, 8) en condiciones normales, la más estable es S8, que se asemeja a una corona en forma. El azufre rómbico y monoclínico se construye a partir de tales moléculas de 8 átomos.

En una escala industrial,propiedades oxidantes de diferentes formas. El ozono se usa para desinfectar el aire y el agua. Pero a concentraciones superiores a 0,16 mg / m3, este gas es peligroso para humanos y animales. El oxígeno molecular es esencial para respirar, se usa en la industria y la medicina. Los alótropos de carbono (diamante, grafito), fósforo (blanco, rojo) y otros elementos químicos juegan un papel importante en la actividad económica.








