Agua de amoníaco: preparación, fórmula, aplicación
Gas incoloro con un fuerte olor a amoníaco NH3 no solo se disuelve bien en agua con liberación de calor. La sustancia interactúa activamente con las moléculas de H2O con la formación de álcali débil. La solución recibió varios nombres, uno de ellos - agua de amoníaco. El compuesto tiene propiedades sorprendentes, que están en el camino de la formación, composición y reacciones químicas.
Formación de iones de amonio

Un ion de amonio con un positivocarga y un tipo especial de enlace covalente débil - donante-receptor. De acuerdo con su tamaño, carga y algunas otras características, se asemeja a un catión de potasio y se comporta como metales alcalinos. Inusualmente químicamente, el compuesto reacciona con ácidos, forma sales que son de gran importancia práctica. Nombres en los que se reflejan las características de la preparación y propiedades de la sustancia:
- agua amoniacal;
- hidróxido de amonio;
- hidrato de amoniaco;
- amonio acre
Precauciones
Se debe tener cuidado cuando se trabaja con amoníaco y sus derivados. Es importante recordar:
- El agua de amonio tiene un olor desagradable. El gas liberado irrita la superficie mucosa de la cavidad nasal, el ojo, causa tos.
- Cuando el amoníaco se almacena en amoníaco en botellas bien cerradas, las ampollas emiten amoníaco.
- Puede detectar sin dispositivos, solo por el olor, incluso una pequeña cantidad de gas en la solución y el aire.
- La relación entre las moléculas y los cationes en la solución varía a diferentes pH.
- En un valor de aproximadamente 7, la concentración de gas tóxico NH3, la cantidad de cationes NH menos dañinos para los organismos vivos aumenta4+
Preparación de hidróxido de amonio Propiedades físicas
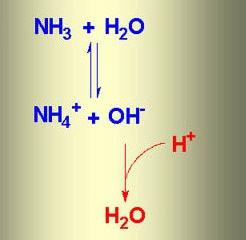
Cuando el amoníaco se disuelve en agua, se forma agua amoniacal. La fórmula para esta sustancia es NH4OH, pero de hecho hay iones simultáneos
NH4+, OH-, NH3 y H2O. En la reacción química del intercambio iónico entre el amoníaco y el agua, se establece un estado de equilibrio. El proceso puede reflejarse por medio de un esquema en el que las flechas opuestas indican la reversibilidad de los fenómenos.
En el laboratorio, la producción de agua amoniacal se lleva a cabo enexperimentos con sustancias que contienen nitrógeno. Cuando se mezcla amoníaco con agua, se obtiene un líquido claro e incoloro. A altas presiones, la solubilidad del gas aumenta. El agua pierde más amoníaco disuelto en ella cuando la temperatura aumenta. Para las necesidades industriales y la agricultura a escala industrial, se obtiene una sustancia del 25 por ciento en la disolución de amoníaco. El segundo método implica usar la reacción del gas del horno de coque con agua.
Propiedades químicas del hidróxido de amonio
Cuando está en contacto, dos líquidos - agua de amoníacoy ácido clorhídrico - están cubiertos con palos de humo blanco. Consiste en partículas del producto de reacción - cloruro de amonio. Con una sustancia volátil como el ácido clorhídrico, la reacción se produce directamente en el aire.

Propiedades químicas débilmente alcalinas del hidrato de amoníaco:
- La sustancia se disocia de forma reversible en agua para formar un catión de amonio y un ion hidróxido.
- En presencia de un NH4+ una solución incolora de fenolftaleína se convierte en un color carmesí, como en los álcalis.
- La reacción química de neutralización con ácidos conduce a la formación de sales de amonio y agua: NH4OH + HCl = NH4Cl + H2O.
- El agua amoniacal entra en reacciones de intercambio iónico con sales metálicas a las que corresponden bases débiles, mientras que se forma un hidróxido insoluble en agua: 2NH4OH + CuCl2 = 2NH4Cl + Cu (OH)2 (precipitado azul).
Agua de amoníaco: aplicación en diferentes ramas de la economía
Una sustancia inusual es ampliamente utilizada en la vida cotidiana,agricultura, medicina, industria. El hidrato de amoníaco técnico se utiliza en la agricultura, la producción de ceniza de sosa, colorantes y otros productos. En el fertilizante líquido, el nitrógeno está contenido en una forma fácilmente asimilable por las plantas. La sustancia se considera la más barata y la más efectiva para su aplicación en el período de precosecha para todos los cultivos.

La producción de agua amoniacal se gasta entres veces menos que la liberación de fertilizantes nitrogenados granulares sólidos. Para el almacenamiento y transporte de líquidos, se utilizan tanques de acero herméticamente sellados. Algunos tipos de pinturas y agentes de blanqueamiento del cabello están hechos con amonio cáustico. En cada institución médica hay medicamentos con alcohol amoniacal, una solución al 10 por ciento de amoníaco.
Sales de amonio: propiedades y significado práctico

Sustancias que se obtienen por interacciónel hidróxido de amonio con ácidos, se usa en actividades económicas. Las sales se descomponen al calentar, se disuelven en agua y se hidrolizan. Entran en reacciones químicas con álcalis y otras sustancias. La importancia práctica más importante fue adquirida por cloruros, nitratos, sulfatos, fosfatos y carbonatos de amonio.
Es muy importante seguir las reglas y medidasseguridad, al trabajar con sustancias que contienen un ion de amonio. Cuando se almacenan en almacenes de empresas industriales y agrícolas, en granjas subsidiarias no debería haber contacto de tales compuestos con cal y álcalis. Si la estanqueidad de los paquetes se rompe, comenzará una reacción química con la liberación del gas tóxico. Todos los que tienen que trabajar con agua amoniacal y sus sales deben conocer los principios básicos de la química. Si se cumplen los requisitos de seguridad, las sustancias utilizadas no dañarán a las personas ni al medio ambiente.




