Fórmula molecular y estructural de metano
Fórmula molecular, estructural y electrónicaEl metano se compila sobre la base de la teoría de Butlerov sobre la estructura de las sustancias orgánicas. Antes de proceder a escribir tales fórmulas, comenzamos con una breve descripción de este hidrocarburo.

Características del metano
Esta sustancia es explosiva, todavía estállamado gas "pantano". El olor específico de este último hidrocarburo es conocido por todos. En el proceso de combustión no quedan componentes químicos que tienen un efecto negativo en el cuerpo humano. Es el metano que participa activamente en la formación del efecto invernadero.
Propiedades físicas
El primer representante de la serie homóloga de alcanosfue descubierto por científicos en la atmósfera de Titán y Marte. Dado el hecho de que el metano está asociado con la existencia de organismos vivos, ha surgido una hipótesis sobre la existencia de la vida en estos planetas. En Saturno, Júpiter, Neptuno, Urano, el metano apareció como un producto del procesamiento químico de sustancias de origen inorgánico. En la superficie de nuestro planeta, su contenido es insignificante.

Características generales
El metano no tiene color, es más ligero que el aire casi endos veces, poco soluble en agua. En la composición del gas natural, su cantidad alcanza el 98 por ciento. El gas que pasa el aceite contiene de 30 a 90 por ciento de metano. En mayor medida, el metano es de origen biológico.
Los herbívoros ungulados y las vacas emiten aprocesando en los estómagos de las bacterias una cantidad bastante significativa de metano. Entre las fuentes importantes de la serie homóloga de alcanos, distinguimos los pantanos, las termitas, la filtración de gas natural y el proceso de fotosíntesis de las plantas. Si se encuentra un rastro de metano en el planeta, podemos hablar de la existencia de vida biológica en él.

Métodos de obtención
La fórmula estructural detallada del metano esconfirmación del hecho de que en su molécula solo se saturan enlaces simples formados por nubes híbridas. Entre las opciones de laboratorio para la producción de este hidrocarburo, destacamos la fusión del acetato de sodio con el álcali sólido, así como la interacción del carburo de aluminio con el agua.
El metano arde con una llama azulada,Esto es alrededor de 39 MJ por metro cúbico. Mezclas explosivas que esta sustancia forma con el aire. El más peligroso es el metano, que se libera durante la extracción subterránea de depósitos minerales en las minas. Existe un alto riesgo de explosión de metano en las plantas de enriquecimiento de carbón y briquetas, así como en las instalaciones de clasificación.
Acción fisiológica
Si el porcentaje de metano en el airees del 5 al 16 por ciento, con la entrada de oxígeno, el metano puede encenderse. En el caso de un aumento significativo en la mezcla de un producto químico dado, la probabilidad de una explosión aumenta.
Si en el aire la concentración de este alcano es del 43 por ciento, es la causa de la asfixia.
Con la velocidad de propagación de la explosión de 500 a 700 metros por segundo. Una vez que el metano se pone en contacto con una fuente de calor, proceso de encendido alcano se produce con un cierto retraso.
Es en esta propiedad donde se basa la producción de equipos eléctricos a prueba de explosiones y componentes explosivos de seguridad.
Como el metano es el más térmicamentehidrocarburo saturado estable, tiene una amplia aplicación en forma de combustible industrial y doméstico, y también se utiliza como una materia prima valiosa para la síntesis química. La fórmula estructural del tri-etil-metano caracteriza las características estructurales de los representantes de esta clase de hidrocarburos.
En el proceso de su interacción química concloro cuando se expone a la radiación ultravioleta, la formación de múltiples productos de reacción. Dependiendo de la cantidad de material de partida puede estar en la sustitución recibir clorometano, cloroformo, tetracloruro de carbono.
En el caso de una combustión incompleta de metano, se forma hollín. En el caso de la oxidación catalítica, se forma formaldehído. El producto final de la interacción con el azufre es el disulfuro de carbono.

Características de la estructura de metano
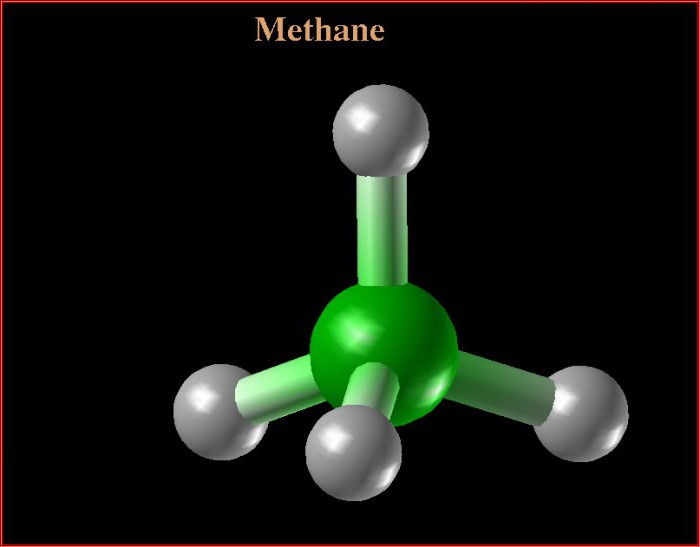
¿Cuál es su fórmula estructural? Metano se refiere a los hidrocarburos limitantes que tienen la fórmula general CnH2n + 2. Considere las características de la formación de una molécula para explicar cómo se forma una fórmula estructural.
El metano consiste en un átomo de carbono y cuatro átomos de hidrógeno unidos por un enlace químico polar covalente. Expliquemos sobre la base de la estructura de las fórmulas estructurales del átomo de carbono.
Tipo de hibridación
La estructura espacial del metano se caracteriza porestructura tetraédrica Como en el nivel exterior de carbono hay cuatro electrones de valencia, cuando el átomo se calienta, el electrón pasa de los segundos orbitales a p. Como resultado, en el último nivel de energía, el carbono tiene cuatro electrones desapareados ("libres"). La fórmula estructural completa del metano se basa en la formación de cuatro nubes híbridas que están orientadas en el espacio en un ángulo de 109 grados 28 minutos, formando la estructura del tetraedro. Luego se produce la superposición de vértices de nubes híbridas con nubes no híbridas de átomos de hidrógeno.
La fórmula estructural completa y abreviada del metano encorresponde completamente a la teoría de Butlerov. Entre el carbono y el hidrógeno, se forma un enlace simple (único), por lo que las reacciones químicas no se caracterizan por reacciones de adición.
A continuación está la fórmula estructural final. El metano es el primer representante de la clase de hidrocarburos saturados, tiene las propiedades típicas del alcano final. La fórmula estructural y electrónica del metano confirma el tipo de hibridación del átomo de carbono en una materia orgánica dada.

Del curso de química escolar
Esta clase de hidrocarburos, representanteque es "gas de pantano", se estudia en el 10 ° grado de la escuela secundaria. Por ejemplo, a los niños se les ofrece una tarea del siguiente personaje: "Escribir las fórmulas estructurales del metano". Es necesario comprender que para esta sustancia, de acuerdo con la teoría de Butlerov, solo se puede escribir una configuración estructural expandida.
Su fórmula reducida coincidirá conmolecular, debe escribirse en forma de CH4. De acuerdo con los nuevos estándares educativos federales introducidos en relación con la reorganización de la educación rusa, en el curso básico de química, se revisan en detalle todas las cuestiones relacionadas con las características de las clases de sustancias orgánicas.
Síntesis industrial
Basado en metano, industrialmétodos de un componente químico tan importante como el acetileno. La base del craqueo térmico y eléctrico es precisamente su fórmula estructural. El metano forma un ácido cianhídrico durante la oxidación catalítica con amoniaco.
Aplica esta sustancia orgánica paraproducción de gas de síntesis Al interactuar con el vapor de agua, se produce una mezcla de monóxido de carbono e hidrógeno, que es la materia prima para la producción de alcoholes monohídricos de límite, compuestos de carbonilo.
De particular importancia es la interacción con el ácido nítrico, lo que resulta en nitrometano.

Aplicación en forma de combustible automotriz
En relación con la falta de fuentes naturaleslos hidrocarburos, así como el empobrecimiento de la base de materia prima, el tema relacionado con la búsqueda de nuevas fuentes (alternativas) para la producción de combustible se vuelve particularmente tópico. Una de esas opciones es el biodiesel, que incluye metano.
Dada la diferencia de densidad entre la gasolinacombustible y el primer representante de la clase alcano, hay ciertas características de su aplicación como fuente de energía para motores de automóviles. Para evitar la necesidad de transportar grandes cantidades de metano, la densidad aumenta por compresión (a una presión del orden de 250 atmósferas). Almacene metano en estado licuado en cilindros instalados en automóviles.
Efectos en la atmósfera
Ya hemos hablado sobre el hecho de que el metano rindeimpacto en el efecto invernadero. Si el grado de acción del monóxido de carbono (4) en el clima se toma condicionalmente para una unidad, entonces la proporción de "gas pantanoso" es de 23 unidades. Durante los últimos dos siglos, los científicos han observado un aumento en el contenido cuantitativo de metano en la atmósfera de la Tierra.
Por el momento, el número aproximado de CH4 se estima en 1.8 partes por millón. A pesar de que esta cifra es 200 veces menor que la presencia de dióxido de carbono, existe una conversación entre científicos sobre el posible riesgo de retención de calor irradiado por el planeta.
En relación con el excelente poder calorífico del "gas del pantano", se utiliza no solo como materia prima en la implementación de síntesis química, sino también como fuente de energía.
Por ejemplo, en el metano hay varias calderas de gas, columnas, diseñadas para sistemas de calefacción individuales en casas privadas y casas de campo.
Tal opción de calefacción autónoma es muy beneficiosapara los propietarios, no está asociado con accidentes que ocurren sistemáticamente en sistemas de calefacción centralizados. Gracias a la caldera de gas que funciona con este tipo de combustible, 15-20 minutos son suficientes para calentar completamente una cabaña de dos pisos.
Conclusión
Metano, fórmulas estructurales y molecularesque se mencionó anteriormente, es una fuente natural de energía. Debido a que en su composición solo hay un átomo de carbono y átomos de hidrógeno, los ecologistas reconocen la seguridad ecológica de este hidrocarburo saturado.
Bajo condiciones estándar (temperatura del aire 20 grados centígrados, presión 101325 Pa), esta sustancia es gaseosa, no tóxica, insoluble en agua.
En el caso de una caída de la temperatura del aire a -161 grados, se comprime el metano, que es ampliamente utilizado en la industria.
El metano tiene un impacto en la salud humana. No es una sustancia tóxica, pero es un gas sofocante. Hay límites incluso (MAC) en el contenido de sustancias químicas en la atmósfera.
Por ejemplo, el trabajo en minas está permitido solo en aquelloscasos, cuando su cantidad no exceda por metro cúbico 300 miligramos. Al analizar las características de la estructura de esta materia orgánica, podemos concluir que es similar en propiedades químicas y físicas a todos los demás representantes de la clase de hidrocarburos saturados (limitantes).
Analizamos las fórmulas estructurales, la estructura espacial del metano. La serie homóloga que inicia el "gas del pantano" tiene la fórmula molecular general CnH2n + 2.






